
- Artículo
- Acceso abierto
- Publicado:
Efectos de diferentes dosis de ejercicio y pérdida de peso inducida por la dieta sobre la función de las células beta en la diabetes tipo 2 (DOSE-EX): un ensayo clínico aleatorizado
- Grit E. Legaard,
- Mark P. P. Lyngbæk,
- Thomas P. Almdal,
- Kristian Karstoft,
- Sebastián L. Bennetsen,
- Camilla S. Feineis,
- Nina S. Nielsen,
- Cody G. Durrer,
- Benedikte Liebetrau,
- Ulrikke Nystrup,
- Martin Østergaard,
- Katja Thomsen,
- Beckey Trinh,
- Thomas P. J. Salomón,
- Gerrit Van Hall,
- Jan Christian Brønd,
- Jens J. Holst,
- Bolette Hartmann,
- Robin Christensen,
- Bente K. Pedersen &
- Mathias Ried-Larsen
Nature Metabolism (2023)Citar este artículo
- 5837 Accesos
- 326 Altmétrico
- Métricasdetails
Abstracto
La pérdida de peso inducida por la dieta se asocia con una mejor función de las células beta en personas con diabetes tipo 2 (DT2) con capacidad secretora restante. Se desconoce si agregar ejercicio a la pérdida de peso inducida por la dieta mejora la función de las células beta y si el volumen de ejercicio es importante para mejorar la función de las células beta en este contexto. Aquí, llevamos a cabo un ensayo aleatorizado de cuatro brazos con un total de 82 personas (35% mujeres, edad media (de) de 58,2 años [9,8]) con DT2 recién diagnosticada (<7 años). Los participantes se asignaron al azar a la atención estándar (n = 20), restricción calórica (reducción de energía del 25%; n = 21), restricción calórica y ejercicio tres veces por semana (n = 20), o restricción calórica y ejercicio seis veces por semana (n = 21) durante 16 semanas. El resultado primario fue la función de las células beta, según lo indicado por el índice de disposición de fase tardía (secreción de insulina multiplicada por la sensibilidad a la insulina) en hiperglucemia en estado estacionario durante una pinza hiperglucémica. Los resultados secundarios incluyeron la secreción y sensibilidad de insulina estimulada por glucosa, así como la disposición, la sensibilidad a la insulina y los índices de secreción derivados de una prueba de tolerancia a comidas mixtas líquidas. Se muestra que el índice de disposición de fase tardía durante la pinza aumenta más en los tres grupos de intervención que en la atención estándar (grupo control de la dieta, 58%; intervalo de confianza [IC] del 95%, 16 a 116; grupo de dosis de ejercicio moderado, 105%; IC del 95%, 49 a 182; grupo de dosis de ejercicio alto, 137%; IC del 95%, 73 a 225) y sigue una relación lineal dosis-respuesta (P > 0.001 para la tendencia). Se informaron tres eventos adversos graves (dos en el grupo control y uno en el grupo control de la dieta), así como eventos adversos en dos participantes en el grupo control de la dieta y cinco participantes en cada uno de los grupos de dosis moderada y alta de ejercicio. En general, agregar una intervención de ejercicio a la pérdida de peso inducida por la dieta mejora la función de las células beta estimuladas por la glucosa en personas con DT2 recién diagnosticada de una manera dependiente de la dosis de ejercicio (NCT03769883).
Principal
Como el deterioro progresivo de la función normal de las células beta se considera un factor determinante para el inicio y la posterior progresión de la DT2, el restablecimiento de la función de las células beta se considera fundamental para mejorar la patogénesis de la DT2.1.
Aunque una pérdida de peso sustancial inducida por la dieta es consistente con una función mejorada de las células beta2,3,4, los efectos del ejercicio sobre la función de las células beta en la DT2 no se comprenden bien5,6,7,8,9. Los hallazgos inconsistentes pueden relacionarse con diferencias en la terapia farmacológica concomitante, la capacidad secretora de insulina de los participantes antes del ensayo o las diferencias en la modalidad de ejercicio, la intensidad y / o el volumen10,11,12,13,14. Las inconsistencias también podrían estar relacionadas con una falla en la corrección de la sensibilidad a la insulina prevaleciente al evaluar la función de las células beta. Como la respuesta fisiológica normal a la disminución de la sensibilidad a la insulina es un aumento en la secreción de insulina, la evaluación de la función de las células beta debe incorporar ambas medidas (es decir, sensibilidad a la insulina y secreción)15. Una medida ampliamente aceptada de la función de las células beta es el índice de disposición (DI), es decir, el producto de la sensibilidad a la insulina y la secreción de insulina.15. Si bien hay evidencia que sugiere que las mejoras inducidas por el ejercicio en la DI se explican a través de mejoras en la sensibilidad a la insulina y la eliminación de glucosa, los efectos inducidos por el ejercicio sobre la secreción de insulina en el contexto de la sensibilidad a la insulina prevaleciente aún no se han aclarado.5,10,16.
Se recomiendan programas intensivos estructurados de control de peso con el objetivo de perder peso junto con la terapia farmacológica para tratar la hiperglucemia.17. La pérdida de peso inducida por la dieta es consistente con mejoras en la función de las células beta2,18, y los medicamentos para reducir la glucosa pueden aumentar la sensibilidad a la insulina, la secreción de insulina y las respuestas de incretina19,20,21. Por lo tanto, se deben considerar las posibles interacciones entre estos tratamientos y el ejercicio al evaluar la función del ejercicio sobre la DI en pacientes con DT2 en un contexto clínico. Como tal, es necesario investigar los efectos potenciales del ejercicio sobre la DI en el contexto de la pérdida de peso dietética estandarizada y la terapia farmacológica.
En consecuencia, el objetivo principal de este estudio fue investigar el cambio en la DI durante los últimos 30 minutos de hiperglucemia inducida por pinza (DI de fase tardía) después de una intervención de 16 semanas con diferentes volúmenes de ejercicio además de la pérdida de peso inducida por la dieta y el manejo farmacológico guiado por algoritmos en personas con DT2 recién diagnosticada. Planteamos la hipótesis de que la DI de fase tardía aumentaría con el aumento de los volúmenes de ejercicio en combinación con la pérdida de peso inducida por la dieta. Además, se esperaba que los volúmenes moderados y altos de ejercicio en combinación con una intervención de pérdida de peso inducida por la dieta fueran superiores al control para mejorar la DI de fase tardía22. El objetivo secundario fue evaluar los efectos de la intervención sobre la sensibilidad y la secreción de insulina. Además, nuestro objetivo fue explorar los efectos sobre los factores de riesgo cardiometabólicos, el metabolismo posprandial de la glucosa, la cinética de la glucosa, la sensibilidad del péptido similar al glucagón 1 (GLP-1) y la capacidad secretora de insulina máxima.
Resultados
Población del ensayo y adherencia a la intervención
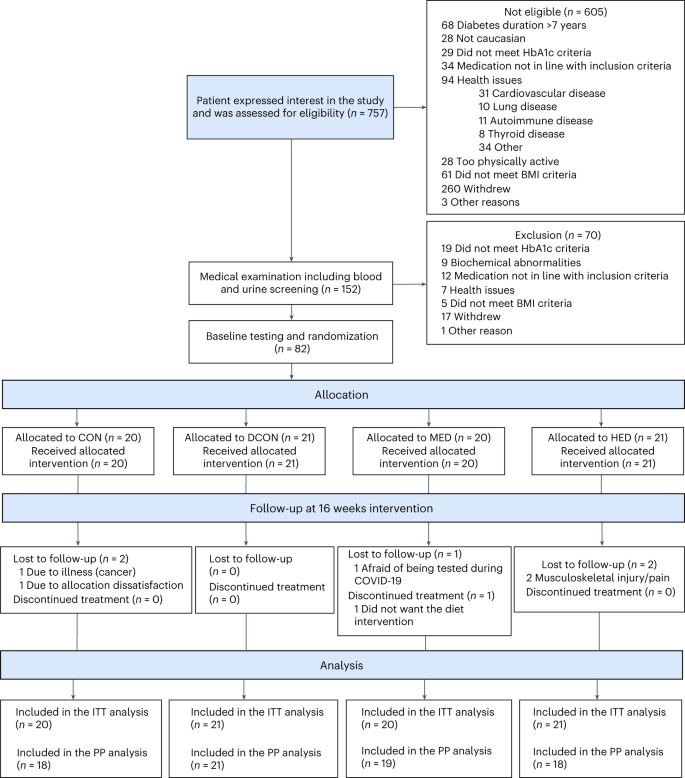
Ochenta y dos personas fueron incluidas en el estudio (Fig. 1). Cinco participantes se perdieron durante el seguimiento: uno se debió a neoplasia maligna, uno no estaba satisfecho con la asignación grupal, uno se abstuvo de realizar pruebas del estudio debido a COVID-19 y dos se debieron a lesiones musculoesqueléticas. La edad media (d.e.) fue de 58,2 años (9,8), el índice de masa corporal (IMC) fue de 33 kg/m2 (3,7), y la hemoglobina glucosilada (HbA1c) fue de 50,2 mmol/mol (6,6). El treinta y cinco por ciento (35%) de los participantes eran mujeres, y la mediana (rango intercuartil [IQR]) de la DT2 fue de 4,0 años (1,9 a 5,5). Las características basales se presentan en la Tabla 1. La adherencia media (d.e.) a la intervención dietética prescrita (~25-30% de déficit de energía por día) fue del 92% (11) para el grupo de control de la dieta (DCON), del 91% (18) para el grupo de dosis de ejercicio moderado (MED) y del 88% (13) para el grupo de dosis de ejercicio alto (HED) (Tabla suplementaria 1). La adherencia media (de) al protocolo de ejercicio prescrito fue del 86% (28) y 93% (18) para HED y MED, respectivamente (Tablas suplementarias 2-7). No se observó una disminución compensatoria en la actividad física total de vida libre en los grupos de intervención durante el período de intervención (Tabla suplementaria 8). La adherencia durante el estudio al tratamiento farmacológico predefinido fue similar entre todos los grupos (Tabla complementaria 9).
Cuadro 1 Características basales
Primary outcome
La DI de fase tardía aumentó en todos los grupos de intervención desde el inicio hasta el seguimiento de 16 semanas, sin cambios en el grupo control (CON) (Fig. 2a) en el análisis por intención de tratar (ITT); como tal, todos los grupos de intervención aumentaron más que la CON (P < 0,005 para todas las comparaciones; Tabla 2). En comparación con la DCN, tanto la MED como la DEH aumentaron la DI de fase tardía (MED versus DCON, 29% [IC del 95%: -5 a 77], P = 0,11; HED versus DCON, 50% (IC del 95%, 10 a 104), P = 0,01) (Tabla 2). La magnitud de los aumentos entre los grupos fue consistente con una relación lineal dosis-respuesta (P para la tendencia <0,001). El conjunto de análisis por protocolo (PP) consistió en CON n = 18 (90%), DCON n = 21 (100%), MED n = 19 (95%) y HED n = 18 (86 %), y siguió el patrón observado en ITT (Tabla 2). La distribución de los valores absolutos al inicio y al seguimiento se presentan en la Fig. 1.
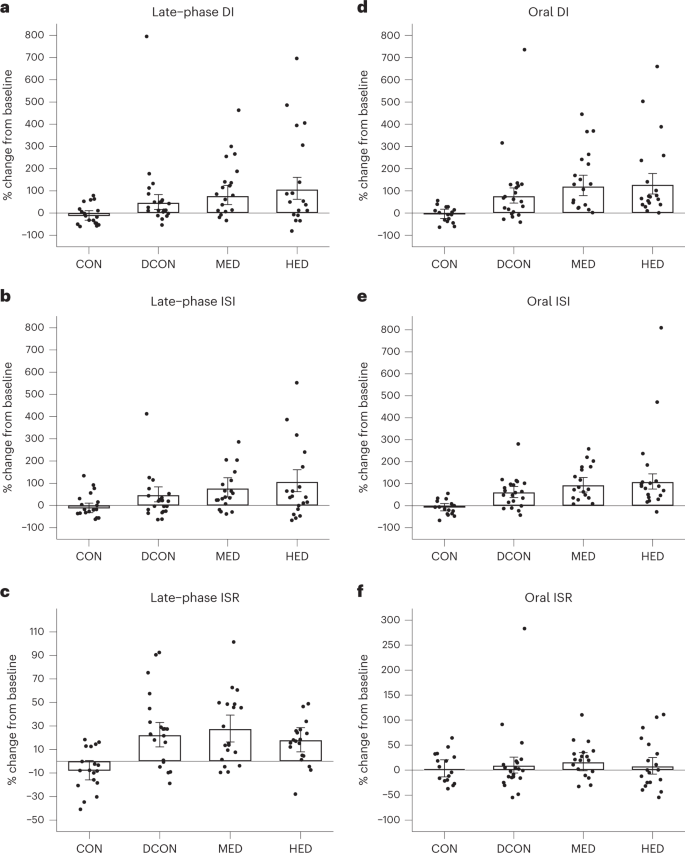
Tabla 2 Comparaciones por pares del cambio en el resultado primario y los resultados secundarios
Resultados secundarios
La relación dosis-respuesta observada para la DI de fase tardía también se reflejó en el índice de sensibilidad a la insulina (ISI) estimulado por glucosa en fase tardía (P para la tendencia <0,001), donde tanto la MED como la HED aumentaron más que la CON, aunque la diferencia entre DCON y CON fue menos pronunciada (Fig. 2b). La DEH se asoció con un mayor aumento de la fase tardía de ISI en comparación con DCON (55% [IC del 95%, 15 a 109], P = 0,004). No se observaron diferencias en la fase tardía del ISI entre DCON y CON. La tasa de secreción de insulina estimulada por glucosa (ISR) de fase tardía aumentó más en todos los grupos de intervención que en CON (Fig. 2c, Tabla 2 y Tablas complementarias 10 y 11), pero no se observaron diferencias entre los grupos restantes.
DI derived from the mixed meal tolerance test (MMTT) (oral DI) increased more in all intervention groups than in CON (Fig. 2d). The MED and HED groups increased more than DCON (MED versus DCON, 25% (95% CI, −5 to 65), P = 0.12; HED versus DCON, 29% (95% CI, −2 to 70), P = 0.065) with no signs of additional increases in HED versus MED (4% (95% CI, −22 to 37), P = 0.81).
All groups increased oral ISI compared with CON (P < 0.001) (Fig. 2e), with more pronounced increases in HED than DCON (29% (95% CI, 3 to 62), P = 0.025) (Table 2). No differences were observed in the oral ISR between the groups (Fig. 2f).
Safety outcomes
Three serious adverse events were observed: one case of transient ischemic attack and one case of malignant melanoma in the CON group, and one case of prolactinoma in the DCON group (Table 3). Two participants in the DCON group, and five participants each in the MED and HED groups reported adverse events. Beyond musculoskeletal complaints and overuse injuries in MED and HED, the nature and frequency were similar between groups.Table 3 Adverse events after randomization
Exploratory outcomes
Supporting clamp-derived indices of beta-cell function
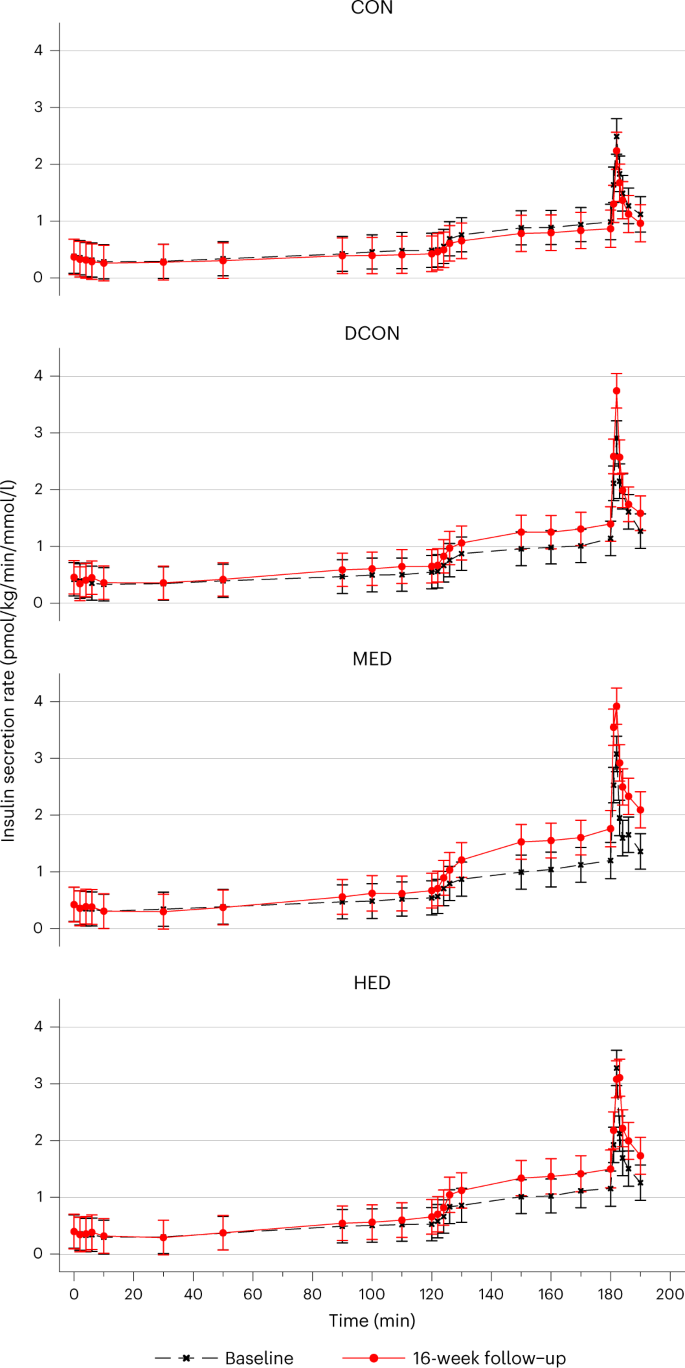
The first-phase (0–10 min of clamp-induced hyperglycemia) DI increased in all intervention groups for all comparisons with CON (P ˂ 0.001; Supplementary Table 11). In addition, both HED and MED increased the first-phase DI more than DCON (HED versus DCON, 37% (95% CI, 6 to 77), P = 0.001; MED versus DCON, 58% (95% CI, 22 to 105), P = 0.017). No difference was observed between HED and MED (Supplementary Table 11). Peak and mean ISR in response to GLP-1 and GLP-1 + arginine infusion increased more from baseline to follow-up in all intervention groups compared with CON (Fig. 3 and Supplementary Tables 10 and 11). Whereas HED did not increase ISR in response to GLP-1 compared with DCON, MED was associated with increased ISR in response to GLP-1 compared with DCON (peak ISR, 0.2 (pmol/kg/min) × mM−1 (95% CI, 0.0 to 0.3), P = 0.019; mean ISR, 0.3 (pmol/kg/min) × mM−1 (95% CI, 0.05 to 0.6), P = 0.045). All intervention groups increased ISR in response to arginine, but no consistent differences were observed among the intervention groups (Supplementary Table 11).
Glucose kinetics
The change in basal rate of glucose appearance (Ra) and disappearance (Rd), and thus the basal endogenous glucose production (EGP), was increased only in HED compared with CON, but no additional differences between the groups were observed. Late-phase Rd and Ra aumentó más en todos los grupos de intervención que en la ECN (p < 0,001 para todas las comparaciones); HED aumentó más que DCON (diferencia en Rd, 0,8 (IC del 95%: 0,2 a 1,4), p = 0,012; diferencia en Run, 0,7 (IC del 95%: 0,1 a 1,3), p = 0,022). Datos completos sobre la velocidad de infusión de glucosa (GIR), EGP, Rd y Run se presentan en la Fig. de datos extendidos. 2 y cuadros suplementarios 10 y 11.
Metabolismo postprandial de la glucosa
La glucosa plasmática posprandial y la insulina disminuyeron más en todos los grupos de intervención que en la ECN (área total bajo la curva [AUUC], t = 0-120 min, P < 0,001). No se observaron diferencias entre los grupos de intervención (Tablas complementarias 10 y 11; el AUC incremental (iAUC) se muestra en las Tablas complementarias 14 y 15). El AUC para la secreción de GLP-1 y polipéptido inhibidor gástrico (GIP) aumentó más en la ECN que en los grupos de intervención desde el inicio hasta el seguimiento (Tablas complementarias 10 y 11). No se observaron diferencias entre los grupos de intervención (Tablas complementarias 10 y 11 y AUC en las Tablas Complementarias 14 y 15). Las respuestas postprandiales se presentan en Extended Data Figs. 3–8.
Peso corporal
El peso corporal disminuyó en 0%, 7%, 10% y 12% desde el inicio en CON, DCON, MED y HED, respectivamente, y disminuyó más en todos los grupos de intervención que en CON (Tablas 4 y 5). Tanto MED como HED redujeron el peso corporal en 3,2 kg (P = 0,043) y 4,5 kg (P = 0,004) más que DCON, respectivamente, sin diferencias en los cambios entre los grupos de ejercicio. El mismo patrón se observó para el IMC (Tablas 4 y 5).Tabla 4 Cambios dentro del grupo (0-16 semanas) en los resultados cardiometabólicos
Mesa de tamaño completoTabla 5 Comparaciones por pares del cambio en los resultados cardiometabólicos
Otros marcadores cardiometabólicos
La HbA1c disminuyó un 0,6% (7 mmol/mol) más en todos los grupos de intervención que en la CON (P < 0,001), pero no se observaron diferencias entre los grupos de intervención (Tablas 4 y 5). El mismo patrón se observó para la glucosa en ayunas, la insulina en ayunas, el péptido C en ayunas, los triglicéridos en ayunas y la presión arterial sistólica (Tablas 4 y 5). Todos los grupos de intervención habían reducido la presión arterial diastólica, y la reducción fue mayor en HED y MED que en DCON. No se observaron reducciones en el colesterol de lipoproteínas de baja densidad (LDL-C). Aptitud física definida como el consumo máximo de oxígeno en ml O2/min (VO2max) aumentó en MED y HED en comparación con CON y DCON, y HED mejoró más que MED. VO2max en relación con el peso corporal definido como ml O2/min/kg (VO relativo2max) cambiaron en −3%, 8%, 23% y 39% en CON, DCON, MED y HED, respectivamente (Tabla 4). La DEH mejoró la prensa torácica máxima (RM) absoluta y relativa al peso corporal 1 repetición en comparación con todos los demás grupos, mientras que las extensiones de pierna de 1 RM en relación con el peso corporal mejoraron en la DEH solo en comparación con la CON y la DCON (Tabla 5).
Análisis de sensibilidad
Los análisis de imputación múltiple sobre los resultados primarios y secundarios concordaron con los análisis primarios (Tabla complementaria 13).
Análisis post hoc
Como resultado post hoc, la necesidad de medicación, después de completar las pruebas de seguimiento, se calculó en función del algoritmo preespecificado. Las reducciones de la medicación hipoglucemiante fueron del 11%, 92%, 81% y 89% en CON, DCON, MED y HED, respectivamente (Tabla 4). Los números correspondientes para las interrupciones de la medicación hipoglucemiante fueron 28%, 39%, 69% y 83%, respectivamente (Tabla 4). Las probabilidades de reducciones e interrupciones fueron mayores en todos los grupos de intervención que en CON (P < 0,05). No se observaron diferencias en las probabilidades de reducciones de la medicación hipoglucemiante entre los grupos de intervención, pero las probabilidades de interrupciones fueron mayores para el HED que para el CON (odds ratio [OR], 2,7 [IC del 95%: 1,1; 7,9]); Tabla 5). Aunque las probabilidades de interrupción fueron mayores en la MED que en la DCON (OR, 3,4 [IC del 95%, 0,6; 21,6]), no alcanzó significación estadística (P = 0,2; Tabla 5). Las probabilidades de interrupción fueron similares entre HED y MED, y no se observaron diferencias en ninguna comparación de grupos para otros medicamentos (Tabla 5).
El papel de la pérdida de peso en los resultados primarios y secundarios se exploró en un análisis estadístico de mediación post hoc (Tabla complementaria 16). Reveló que el efecto del tratamiento mediado por la pérdida de peso en la fase tardía de DI fue similar en todos los grupos de ejercicio y representó alrededor del 50-60% del efecto total, mientras que el 70% del efecto del tratamiento fue mediado por la pérdida de peso en DCON. Con respecto a la fase tardía de ISI, el patrón fue similar para los grupos de ejercicio, pero para DCON, la pérdida de peso fue totalmente responsable del efecto del tratamiento. La pérdida de peso no explicó el aumento en la ISR de fase tardía.
Discusión
Uno de los hallazgos principales es que todos los grupos de intervención mejoraron la función de las células beta, expresada por la DI de fase tardía, más que la atención estándar. Además, agregar ejercicio a la pérdida de peso inducida por la dieta mejoró la función de las células beta más que la pérdida de peso inducida por la dieta o la atención estándar sola. Esto pareció lograrse mediante aumentos adicionales en la sensibilidad a la insulina inducida por el ejercicio de una manera dependiente de la dosis. Sin embargo, los resultados secundarios y exploratorios no apoyaron uniformemente la relación dosis-respuesta lineal observada para el resultado primario.
Hay una escasez de estudios que investiguen el papel del ejercicio y el volumen de ejercicio junto con la pérdida de peso inducida por la dieta, pero nuestras observaciones están en línea con hallazgos previos que sugieren que los altos volúmenes de ejercicio sin una intervención dietética concomitante mejoran la primera fase y / o la DI de fase tardía en personas con prediabetes y DT2.5,12,23. En línea con otros estudios, nuestros datos apoyan que el componente de ejercicio aumenta la DI debido a aumentos en la sensibilidad a la insulina en lugar de una mayor secreción de insulina.5,12,23,24. En contraste, otros estudios han demostrado que el ejercicio puede aumentar la secreción de insulina y no la sensibilidad a la insulina en personas con disglucemia.6,8. Una razón para la discrepancia puede ser los niveles más altos de pinza de glucosa (25 mmol / l) utilizados en ref. 6 en comparación con la glucosa plasmática de ~13 mmol / L utilizada en nuestro estudio. A niveles de pinza más cercanos a nuestro objetivo (~ 13 mmol / l de glucosa plasmática), los investigadores en ref. 6 tampoco observó un aumento en la secreción de insulina. Las diferencias también podrían relacionarse con las intensidades del ejercicio en los estudios en los que, para un aumento dado en la sensibilidad a la insulina, se ha demostrado que el ejercicio de alta intensidad da como resultado una mayor reducción en la secreción de insulina que el ejercicio de baja intensidad a moderada12.
Aunque no se observó una diferencia en la ISR de fase tardía con el aumento del volumen de ejercicio en comparación con la pérdida de peso inducida por la dieta sola, todos los grupos de intervención mostraron aumentos similares en la ISR de fase tardía. Por lo tanto, se podría especular que la pérdida de peso inducida por la dieta por sí sola podría explicar esta observación y que una pérdida de peso de ~ 7.5% de peso corporal puede ser suficiente para restablecer la ISR de fase tardía en esta población de estudio. Apoyando esto, un estudio previo de nuestro grupo, utilizando el mismo protocolo de intervención que para HED, también aumentó la DI. De acuerdo con nuestros hallazgos actuales, solo la mejora en el índice de sensibilidad a la insulina, y no el pequeño aumento en la secreción de insulina, se asoció con el volumen de ejercicio en ese estudio.10. Tomados en conjunto, estos hallazgos sugieren que los cambios en la sensibilidad a la insulina son más impulsados por el ejercicio, mientras que los cambios en la secreción de insulina son impulsados principalmente por la pérdida de peso. En apoyo adicional de esto, estudios previos han demostrado un aumento de la capacidad secretora de insulina después de la restricción calórica con una mejoría nula o marginal en la sensibilidad periférica a la insulina; por lo tanto, la DI de primera fase, fase tardía y fase total se explican principalmente por aumentos en la secreción de insulina3,18,25. The increased first-phase ISR following diet-induced weight loss is consistent with findings of other studies3,26 and may relate to a decrease in fasting plasma glucose (which was comparable between the intervention groups in our study)27. However, it was surprising that exercise was associated with an attenuation of the increase in first-phase ISR induced by diet-induced weight loss. When first-phase DI was calculated (correcting the ISR for insulin sensitivity), the increase was larger in the exercising groups than with diet-induced weight loss alone. Although there seems to be a consensus that regaining first-phase insulin secretion is characteristic of T2D remission, we found a reduction when exercise was added to a diet-induced weight loss intervention. An explanation may relate to both improved insulin sensitivity and glucose effectiveness observed with exercise5,16, or could be ascribed to a blunted insulin secretion during hyperglycemia, GIP stimulation and arginine stimulation after high volumes of exercise28,29,30. The HED group may have experienced an exercise-induced blunting of insulin secretion whereas MED did not, which could also explain why there were no further increases in ISR, first-phase DI, GLP-1 stimulation and arginine stimulation despite the largest late-phase ISI being in HED. The metabolic consequences of a slightly blunted insulin secretion in people with T2D are unknown. Nevertheless, exercise-induced decreases in insulin secretion during concomitant increases in insulin sensitivity are consistently found in individuals with prediabetes and/or obesity, as well as in healthy people12,23,28. Dado que la secreción de insulina contrarresta fisiológicamente la sensibilidad a la insulina como respuesta homeostática15,31, un aumento inducido por el ejercicio en la sensibilidad a la insulina agregado a la pérdida de peso inducida por la dieta puede reducir la demanda de células beta, ofreciendo reposo de células beta y, por lo tanto, preservando la salud de las células beta.
En este estudio, tanto la DI de fase tardía como la ISI de fase tardía aumentaron linealmente con el aumento de la intensidad del tratamiento. Sin embargo, no se observó una relación similar durante el MMTT ni en la primera fase DI o las estimulaciones GLP-1 y arginina. Aunque especulativo, esto puede relacionarse con la vía de administración de glucosa. Recientemente, se describió que el aumento de la secreción de insulina observado después de la administración oral de glucosa en comparación con la administración intravenosa podría ir acompañado de una disminución compensatoria en la sensibilidad a la insulina.32. Además, la respuesta de incretina durante el MMTT podría activar una vasoconstricción inducida por GIP en la microvasculatura de los músculos esqueléticos.33, que podría amortiguar una diferencia en la acción de la insulina entre los grupos de ejercicio lograda por la capilarización del músculo esquelético inducida por el ejercicio34.
Estos hallazgos sugieren que solo hay un efecto limitado de aumentar el volumen de ejercicio de tres a seis sesiones semanales en el contexto de la pérdida de peso inducida por la dieta. Del mismo modo, aunque la pérdida de peso fue mayor en ambos grupos de ejercicio en comparación con la pérdida de peso inducida por la dieta sola, no hubo pérdida de peso adicional aparente al duplicar el volumen de ejercicio de tres a seis sesiones por semana. Por el contrario, el aumento tanto en el VO absoluto como en el relativo2max se asoció positivamente con la dosis de ejercicio, con solo diferencias marginales en la fuerza máxima.
Aunque una pérdida de peso del ≥5% puede aumentar ligeramente la función de las células beta, puede ser necesaria una pérdida de peso del ≥11% para maximizar un aumento en la sensibilidad periférica a la insulina en personas con obesidad2. Sin embargo, se han reportado pérdidas de peso inducidas por la dieta de ≥15 kg que resultan en mejoras significativas en la función de las células beta en personas con DT2 sin aumentos concomitantes en la sensibilidad periférica a la insulina.3.
Aún así, la pérdida de peso inducida por la dieta puede mejorar principalmente la sensibilidad a la insulina hepática (central) y la capacidad secretora de insulina de las células beta a través de reducciones en la grasa visceral y ectópica (es decir, en el hígado y el páncreas) que confieren un aumento dependiente de la dosis en la función de las células beta.3,4. Esto podría explicar por qué el análisis de mediación estadística post hoc sugirió que el papel de la pérdida de peso en el efecto de la intervención medió todo el efecto de la fase tardía del ISI en la DCON. Por el contrario, el ejercicio mejora principalmente la sensibilidad periférica a la insulina35 y puede explicar por qué solo el 50-60% del efecto de la intervención fue mediado por la pérdida de peso en la fase tardía del ISI cuando se agregó ejercicio a la dieta. Como tal, la pequeña pérdida de peso adicional observada en los grupos de ejercicio en comparación con DCON probablemente no explica por sí sola el efecto adicional sobre la fase tardía de ISI. Estos hallazgos apoyan que el ejercicio puede mejorar la función de las células beta al aumentar la sensibilidad periférica a la insulina más allá de los efectos de la reducción de peso sola.34,35,36.
Curiosamente, la pérdida de peso medió completamente los efectos de la intervención en la DI oral y la ISI oral, lo que sugiere que la pérdida de peso se convierte en la señal más importante en el contexto de una comida mixta oral y la regulación postprandial homeostática normal. Aunque especulativo, esto puede relacionarse no solo con la compleja diafonía de órganos neuronales y endocrinos, sino también con la composición de la comida en la que ciertos aminoácidos y ácidos grasos regulan la secreción de insulina, así como el flujo sanguíneo microvascular del músculo esquelético.
Limitaciones
Nuestros hallazgos deben interpretarse en el contexto de las limitaciones del estudio. Primero, el tamaño de la muestra se basó en un estudio previo que incluyó hasta cinco sesiones de ejercicio aeróbico por semana. Por lo tanto, la falta de diferencias entre MED y HED o DCON y MED podría ser un error de tipo 2 debido al bajo poder estadístico. Sin embargo, dada la señal consistente en la mayoría de los índices de células beta, los resultados pueden interpretarse con confianza. En segundo lugar, evaluamos la DI de células beta con una pinza hiperglucémica. Aunque la pinza hiperglucémica es el estándar de oro para la función de las células beta15, es una evaluación no fisiológica que limita la traducción fisiológica. Sin embargo, pinzamos el nivel de glucosa a solo 5.4 mmol / l por encima del nivel de glucosa en ayunas, tratando de imitar los niveles de glucosa postprandial. Además, evaluamos los índices de células beta durante un MMTT para comparar la pinza hiperglucémica suprafisiológica (niveles de glucosa ~ 13 mmol / l al inicio y seguimiento) con las condiciones fisiológicas durante el MMTT (niveles máximos de glucosa ~ 16 mmol / l durante MMTT al inicio del estudio). Debido a que observamos un patrón consistente entre la pinza hiperglucémica y MMTT, esto permite traducir los hallazgos de la pinza hiperglucémica a un contexto fisiológico. En tercer lugar, aplicamos restricciones farmacológicas, y los participantes fueron diagnosticados relativamente recién y farmacológicamente bien regulados antes de la aleatorización, así como durante todo el estudio. Por lo tanto, no es posible traducir directamente los resultados a los pacientes con una duración más prolongada de la DT2, tratados con otros agentes farmacológicos o que tienen un control glucémico deficiente. Sin embargo, como nuestros hallazgos son consistentes con los ensayos farmacológicos de pérdida de peso37, todavía pueden tener implicaciones clínicas. Cuarto, la intervención fue de sólo 16 semanas. La disminución de los beneficios con respecto a los índices de células beta al pasar de tres a seis sesiones de ejercicio por semana podría deberse a los efectos techo para el curso temporal de la intervención. Por lo tanto, tres sesiones de ejercicio por semana combinadas con un déficit de energía del 25% pueden saturar casi por completo la tasa de adaptación de los mecanismos que influyen en la función de las células beta. Además, los cambios específicos de órganos en respuesta al ejercicio crónico pueden ocurrir en diferentes cursos de tiempo y también reflejarán las respuestas individuales al ejercicio.35,38. Por lo tanto, 16 semanas pueden haber sido demasiado cortas para ver desviaciones significativas entre MED y HED o incluso de DCON. En quinto lugar, no se utilizó la pinza hiperinsulinémica-euglucémica estándar de oro para evaluar la sensibilidad a la insulina; Sin embargo, la pinza hiperglucémica proporciona una medida confiable de la eliminación de glucosa15,39. Además, observamos que la fase tardía de EGP no cambió mientras que Rd aumentó en comparación con la CON, lo que sugiere un aumento de la sensibilidad periférica a la insulina y no de la sensibilidad a la insulina hepática. En sexto lugar, se evaluó la adherencia dietética mediante el autoinforme, que puede incluir sesgo de información40. Séptimo, aunque la DI se considera la evaluación más precisa de la función de las células beta.15, la relación entre la secreción de insulina y la sensibilidad a la insulina no es consistentemente hiperbólica a través de los niveles de tolerancia a la glucosa, IMC o mediciones de DI31. Además, un aumento de la DI de las células beta no implica necesariamente una mejor salud de las células beta. Esto se debe a que un aumento en la DI a través de una mayor demanda de secreción de insulina para compensar la disminución de la sensibilidad a la insulina (es decir, una mayor carga alostática) se ha asociado con el deterioro de la función de las células beta en comparación con el aumento de la DI a través de una mejor sensibilidad a la insulina.31,41,42. Por lo tanto, evaluamos tanto la secreción de insulina como la sensibilidad a la insulina para calcular la DI de las células beta, y nuestros resultados están en línea con los estudios preclínicos y clínicos que sugieren que el aumento de la DI de las células beta a través de la sensibilidad a la insulina es beneficioso para la salud de las células beta.
Conclusión y perspectivas
Entre los adultos con DT2 dentro de los 7 años posteriores al diagnóstico, el ejercicio además de la pérdida de peso inducida por la dieta aumenta la DI de fase tardía a lo largo de una intervención de 16 semanas. Los beneficios más pronunciados se observaron con el ejercicio seis veces por semana.
La dirección de los efectos del ejercicio sobre la DI oral y la ISI oral son consistentes con un beneficio adicional cuando se agrega a la pérdida de peso inducida por la dieta. En contraste con la relación lineal dosis-respuesta observada con la estimulación de glucosa solamente, el DI oral y el ISI oral mostraron una relación curva-lineal con rendimientos disminuidos al comparar tres y seis sesiones de ejercicio por semana. Por lo tanto, los datos de la estimulación de la comida sugieren que aumentar la dosis de ejercicio más allá de tres veces por semana puede ser redundante para obtener beneficios adicionales del ejercicio en la función de las células beta cuando se realiza junto con la pérdida de peso inducida por la dieta. Se necesita más investigación para confirmar esto.
Métodos
Diseño del estudio
El estudio fue un ensayo clínico aleatorizado de 16 semanas, de grupos paralelos, de cuatro brazos, ciego al evaluador, realizado entre febrero de 2019 y octubre de 2021 en el Centro de Investigación de la Actividad Física (CFAS), Rigshospitalet, Copenhague, Dinamarca. El estudio fue prerregistrado en ClinicalTrials.gov (NCT03769883) y fue aprobado por el Comité de Ética Científica de la Región Capital de Dinamarca (número de aprobación H-18038298) antes del comienzo de cualquier procedimiento de estudio. Se siguieron las directrices de la Declaración de Helsinki, y los datos se informan siguiendo la directriz CONSORT para ensayos de múltiples brazos.43 y las normas REPORT43. El protocolo del estudio para este ensayo clínico está disponible en la Información complementaria y se ha publicado anteriormente22. El plan de análisis estadístico completo (SAP) preespecificado se completó y se cargó en nuestro sitio web antes de comenzar cualquier análisis estadístico (https://aktivsundhed.dk/images/docs/SAP_doseex_nov21.pdf).
Participantes y criterios de elegibilidad
Los participantes fueron reclutados a través de los medios de comunicación, los municipios y las autoridades danesas de datos de salud. Los participantes potenciales contactaron a la enfermera del estudio y completaron el proceso de selección antes del examen médico. Los principales criterios de inclusión fueron (1) hombres y mujeres de 18 a 80 años, (2) diagnosticados con DT2 dentro de los <7 años, (3) ningún tratamiento actual con insulina y (4) IMC > 27 kg / m2 y <40 kg/m2. Todos los participantes proporcionaron su consentimiento informado escrito y oral antes de cualquier prueba.
Intervenciones
CON recibió atención estándar y se le alentó a mantener la actividad física habitual y los hábitos dietéticos durante todo el estudio. DCON recibió atención estándar e intervención dietética. MED recibió atención estándar, intervención dietética y una intervención de ejercicio con dos sesiones de entrenamiento aeróbico por semana y una sesión combinada de entrenamiento aeróbico y de resistencia por semana, totalizando 150-165 min de entrenamiento físico por semana. HED recibió la atención estándar y las intervenciones dietéticas descritas anteriormente, pero tuvo el doble de ejercicio que MED, con un total de cuatro sesiones de entrenamiento aeróbico por semana y dos sesiones combinadas de entrenamiento aeróbico y de resistencia por semana, totalizando 300-330 min de entrenamiento físico por semana.
Componente de atención estándar
La atención estándar incluyó el tratamiento farmacológico de la glucemia, los lípidos sanguíneos y la presión arterial de acuerdo con un algoritmo preespecificado y fue manejada por un endocrinólogo que fue cegado para la asignación de participantes22. Para minimizar la influencia en los hallazgos de un control deficiente de la glucosa al ingresar al estudio, se introdujo la estandarización médica de acuerdo con el algoritmo preespecificado de tratamiento a objetivo durante 6 semanas antes de las mediciones iniciales. Además, el tratamiento farmacológico se evaluó según el algoritmo siguiendo las mediciones basales y en la semana 12 de la intervención. Los objetivos del tratamiento estaban en línea con las directrices actuales. En complemento del algoritmo, el tratamiento farmacológico se adaptó para mitigar los signos subjetivos de hipotensión o hipoglucemia. Los lípidos sanguíneos, la presión arterial y la glucemia se midieron antes de la intervención y 4, 12 y 16 semanas después de la intervención. En caso de cualquier evento adverso, se aconsejó a los participantes que se pusieran en contacto con la enfermera del estudio. En cada visita, la enfermera del estudio entrevistó a todos los participantes sobre los posibles eventos adversos. La definición de eventos adversos siguió las directrices ICH E2A44.
Dietary component
Daily energy requirements were estimated using the age-adjusted Oxford equation45. The dietary intervention aimed at ~25–30% energy deficit per day with a macronutrient distribution within the range of 45–60 energy percent (E%) carbohydrate, 15–20E% protein and 20–35E% fat (<7E% saturated fat). The intervention consisted of individualized recommendations and recipes. A clinical dietician implemented the plan at three sessions during the intervention, and adjustments were performed based on self-reported, 3-day food records.
Exercise component
The exercise intervention consisted of both aerobic and resistance training, and the first 2 weeks served as a familiarization period. The aerobic training sessions of 30-min duration had a target intensity of 60–100% of maximal heart rate (HRmax). Throughout the intervention, the relative time spent exercising in intensity zone 80–100% of HRmax was increased, and the relative time spent in the intensity zone 60–79% of HRmax was reduced accordingly. Resistance training was added in combined sessions with 30 min of aerobic training and 30–45 min of resistance training. The resistance training consisted of three sets in the main muscle groups, for example, chest press, leg press, back row, and leg extension. The 8–12 repetitions aimed at a resistance consistent with 0–3 repetitions in reserve46. All heart-rate profiles were recorded during the exercise interventions (Polar V800), and all training sessions were supervised by educated trainers.
Experimental days
Two experimental days were conducted at baseline and repeated at 16-week follow-up. Forty-eight hours before the experimental days, the participants were instructed to discontinue glucose-lowering medication use and refrain from any exercise. Moreover, no alcohol or caffeine was permitted 24 h before the visits, and the participants were instructed to maintain their habitual diet. The participants arrived at the testing facilities at 07:30 am after an overnight fast (≥10 h fasting). Experimental days 1 and 2 were planned to be separated by 1 week.
Experimental day 1
The participants completed a 3-h MMTT. The liquid meal was prepared using 400 ml of Nestlé Resource with an additional 36 g of dextrose (total energy content, 735 kcal; E%, 64/24/12 carbohydrate/fat/protein). Paracetamol (1.5 g) was added to assess gastric emptying. Body weight was measured with an electronic scale, and height was measured with a Holtain stadiometer according to standard procedures. VO2max was assessed using indirect calorimetry (Quark CPET, Cosmed) on a Monark LC4 bicycle (Monark Exercise). The test was performed with a 5-min warm-up followed by increases of 20 watts/min until exhaustion. Maximum muscle strength was assessed by two exercises performed in resistance training machines (chest press, leg extension) via estimating the maximum weight (kg) that could be lifted once with a full range of motion with proper form (that is, 1 RM).
Experimental day 2
A three-stage hyperglycemic clamp was performed. After baseline blood sampling, a priming bolus of [6,6-2H2]glucose was injected intravenously and a continuous tracer infusion was initiated. The bolus dose and infusion rate of the tracer depended on the participant’s fasting glucose level and body weight as described elsewhere5. Después de 2 h de infusión del marcador, la hiperglucemia se introdujo mediante el pinzamiento de glucosa a 5,4 mM por encima de la glucosa en ayunas (mientras que el nivel absoluto de glucosa de pinza posterior a la intervención fue igual al nivel de pinza previo a la intervención). Un aumento inicial en la glucosa en sangre fue provocado por una infusión de glucosa de onda cuadrada que duró 15 minutos. Después de esto, la concentración de glucosa se mantuvo constante ajustando las GIR basadas en mediciones de glucosa en sangre (serie ABL 8, radiómetro) realizadas cada 5 minutos de acuerdo con un algoritmo automatizado.5. Después de 2 h de hiperglucemia, se inició una infusión continua de GLP-1 a una velocidad de 0,5 pmol/kg/min, y después de 1 h de hiperglucemia + infusión de GLP-1, se administró un bolo intravenoso de clorhidrato de arginina (5 g administrados durante 30 s) para proporcionar un estímulo máximo a las células beta, lo que lleva a la secreción de vesículas intracelulares restantes de insulina. Antes del muestreo inicial, el participante anuló. Cada vez que el participante vaciaba durante la pinza, la orina se acumulaba y la concentración de glucosa urinaria se medía al final del procedimiento.
Medidas de vida libre
Las evaluaciones de la actividad física de vida libre y la presión arterial fueron registradas por los participantes entre los 2 días de estudio. La actividad física también se evaluó con monitores de actividad física (AX3, Axivity) durante 7 días consecutivos. La presión arterial se evaluó con mediciones de reposo en el hogar durante 3 días, incluidas tres mediciones por la mañana y por la noche. Además, se completó un registro de 3 días de la ingesta dietética total al inicio del estudio, durante el período de intervención (en las semanas 4 y 12) y durante los 3 días previos a las pruebas de seguimiento.
Análisis de muestras de sangre
Las muestras de sangre (insulina plasmática, péptido C, glucosa, HbA1c, LDL-C, triglicéridos y paracetamol) se analizaron en el Departamento de Bioquímica Clínica, Rigshospitalet, utilizando procedimientos estándar. GLP-1 y GIP se analizaron mediante radioinmunoinmunoensayos carboxiterminales internos. El ensayo GLP-1 total (nombre en clave 89390) se basa en el extremo COOH amidado y, por lo tanto, mide GLP-1(7–36)NH2 y GLP-1(9–36)NH2. Los resultados del ensayo, por lo tanto, reflejan la tasa de secreción de GLP-1 (refs. 47,48). El ensayo GIP total (nombre en clave 80867) reacciona completamente con GIP intacto y formas truncadas amino-terminalmente49. El marcador de glucosa [6,6-2H2]la glucosa se utilizó para mediciones de R en todo el cuerpoun y Rd de glucosa durante la hiperglucemia en estado estacionario y se calculó mediante ecuaciones de estado no estacionario50 Adaptado para isótopos estables51,52.
Compensación de los participantes
Todos los participantes recibieron hasta 6.000 DKK (800 €) en total para cubrir la pérdida de ingresos, el transporte y el malestar. La transacción se completó al finalizar el estudio (los cuatro días completos de laboratorio (V1, V2, V6 y V7) o al retirarse). Por cada día completo de pruebas de laboratorio, los participantes recibieron DKK 1,000. Además, se agregaron 500 DKK en compensación por biopsia (hasta cuatro en total). Para evitar pérdidas durante el seguimiento en el grupo CON, ofrecimos tres sesiones de entrenamiento supervisado y una membresía gratuita de 16 semanas en un gimnasio después de la prueba final.
Resultados
Resultado primario
El resultado primario fue el cambio en la DI de fase tardía desde el inicio hasta el seguimiento de 16 semanas, lo que refleja la respuesta de las células beta durante los últimos 30 minutos de la etapa hiperglucémica15. La DI se calculó como el producto de la ISR de fase tardía y la ISI de fase tardía (resultados secundarios designados, ver más abajo).
Resultados secundarios
Los resultados secundarios se especificaron previamente en el PAE (designado «Resultados secundarios principales» en el PAE) e incluyeron la ISR de fase tardía, la ISI de fase tardía derivada durante los últimos 30 minutos del estadio hiperglucémico y la DI oral, la ISI oral y la ISR oral derivada del TTMM.53. La ISR de fase tardía se calculó a partir de las mediciones del péptido C desconvolucionado54 y posteriormente normalizado a concentraciones ambientales de glucosa en sangre. La fase tardía del ISI se calculó como la RGI dividida por el producto de la insulina y la glucosa.39. La DI oral se calculó como el producto de la ISI oral y la ISR oral. El ISI oral (el índice de Matsuda) se calculó como 10.000/√ (glucosa en ayunas × insulina en ayunas) × (glucosa media0–120min × insulina media0–120min), y la ISR oral se calculó como el AUC para la glucosa dividido por el AUC para la insulina del tiempo 0 al 120 min durante el MMTT53.
Exploratory outcomes
The exploratory outcomes (designated ‘Other secondary outcomes’ in the SAP) included the change (baseline to 16-week follow-up) in first-phase ISR, EGP, first-phase DI, ISI and ISR, as well as HbA1c, LDL-C, fasting glucose, fasting insulin, fasting C-peptide, fasting triglycerides, systolic blood pressure, diastolic blood pressure, body weight, absolute VO2max, relative VO2max, 1 RM for chest press and leg extension (both absolute and relative to body weight), and tAUC and iAUC in glucose, insulin, C-peptide, GLP-1, GIP and paracetamol from the MMTT. AUCs for the different time periods were calculated using the trapezoidal rule. Ra and Rd were calculated from glucose tracers during clamp-induced steady-state hyperglycemia. Adverse events were self-reported.
Post hoc outcomes
Post hoc outcomes included intensification (yes or no), reduction (yes or no) and discontinuation (yes or no) for glucose-lowering and blood pressure-lowering medications. Due to restrictions in our pharmacological treatment algorithm regarding lipid-lowering medications, only intensifications were assessed for this outcome.
Randomization and blinding
The participants were randomly allocated to the four intervention arms upon successful completion of the baseline measurements. An independent statistician (author R.C.) prepared a computer-generated randomization schedule in a ratio of 1:1:1:1, stratified by sex. To ensure concealment, the (permuted) block sizes were not disclosed. The schedule was forwarded to a secretary who was not involved in any study procedures and stored on a password-protected computer. Sequentially numbered, opaque, sealed envelopes were prepared and stored in a locked cabinet before commencing the recruitment. The envelopes were lined with aluminum foil to render the envelope impermeable to intense light. Following the conclusion of the hyperglycemic clamp, the appropriate envelope was opened by a study nurse, and the participant was informed about the allocation stated on the card inside the envelope. The participant received the allocation in a closed room. As such, the participants were blinded for treatment allocation until after the completion of the hyperglycemic clamp. Following the baseline assessment, blinding of the participants was no longer possible. Both study personnel involved with the data collection and the study endocrinologist managing pharmacological treatment and safety were blinded to allocation. The clinical results used for pharmacological management and safety assessment were presented to the endocrinologist by the study nurse without disclosing participant allocation.
Sample size and power considerations
We expected that an exercise intervention would increase the late-phase DI by 1.5 arbitrary units (a.u.) more than the control group, with a standard deviation of 1.5 a.u. of the change in the exercise and 1.0 a.u. in the control group5. For a contrast in a one-way analysis of variance (ANOVA) with four means (1.5, 1.0, 0.5, 0.0) and contrast coefficients (1, 0, 0, −1) using a two-sided significance level of 0.05, assuming an error standard deviation of 1.5 and a balanced design, a total sample size of 80 participants in the PP population (approximately 20 participants in each group) would yield statistical power of 87.7%.
Análisis estadístico
De acuerdo con el protocolo y el PAE, el análisis del resultado primario se basó en la población observada (los datos faltantes no se imputaron en el análisis primario)55,56, así como la población del PP. El «Conjunto de análisis completo» para la población ITT incluyó a todos los participantes asignados al azar independientemente de su cumplimiento con las intervenciones. Los criterios de la población PP incluyeron (1) completar la evaluación de resultado primario (todos los grupos), (2) cumplir con el protocolo de dieta definido como estar dentro del ±30% de la ingesta de energía prescrita (DCON, MED y HED), y (3) el cumplimiento del protocolo de entrenamiento físico definido como completar el ≥70% del volumen de ejercicio prescrito durante el período de intervención (de las semanas 2 a 16) (MED y HED). Se asumió que los datos faltantes faltaban al azar. Los datos continuos, incluidos los resultados primarios, secundarios y exploratorios, se analizaron mediante un análisis longitudinal de línea de base restringido a través de un modelo mixto lineal.57. Como el valor inicial es parte del vector de resultado, todos los participantes con al menos una medición (inicial o de seguimiento) se incluyeron en los análisis.57. El modelo incluyó efectos fijos para el tiempo (dos niveles), el tratamiento (codificado 0 para todos los grupos al inicio y codificado 0, 1, 2 o 3 en el seguimiento para CON, DCON, MED y HED, respectivamente) y sexo (dos niveles), así como el identificador único del paciente como efecto aleatorio. El análisis poblacional de PP potencialmente sesgado se ajustó aún más para los supuestos factores de confusión: duración de la diabetes y consumo máximo de oxígeno basal (ml O2/kg/min). Los datos se presentan como la diferencia en los cambios medios con intervalos de confianza del 95%, a menos que se indique lo contrario. La adecuación de los modelos se investigó a través de los valores y residuos predichos. Si se violaban los supuestos del modelo, los análisis se realizaban utilizando los datos transformados en logaritmo y posteriormente se exponenciaban para su interpretación. Los datos retrotransformados se expresaron como la relación de la media geométrica y se interpretaron como un cambio porcentual desde el inicio (dentro del grupo) o una diferencia en el cambio entre los grupos. Se examinó una tendencia lineal (interpretada como una relación lineal dosis-respuesta) tratando cada categoría de tratamiento como una variable continua en el modelo principal y se probó mediante una prueba de Wald (valor de p informado). La linealidad se inspeccionó visualmente, y la P para la tendencia se calculó solo para los resultados primarios y secundarios en la medida en que la relación fue lineal (es decir, para DI de fase tardía e ISI de fase tardía). Los análisis de sensibilidad se realizaron utilizando múltiples procedimientos de imputación lineal con el cambio en los resultados (valores post-pre)55. El modelo incluyó todas las covariables incluidas en el modelo principal, y el coeficiente beta y los errores estándar se basaron en 30 conjuntos de datos imputados y se ajustaron para la variabilidad entre imputaciones.58. Los resultados dicotómicos se analizaron mediante análisis de regresión logística. Como la escasez de resultados dicotómicos (como se esperaba para los medicamentos) invalida los intervalos de confianza, se utilizó la regresión logística exacta (exlogística en Stata) cuando los casos fueron <559,60. Se realizó un análisis estadístico de mediación post hoc para examinar el grado en que el efecto del tratamiento observado (en los grupos de intervención) sobre los resultados primarios y secundarios estuvo mediado por el cambio en el peso corporal. Se realizó un análisis estadístico exploratorio de mediación en R61 to examine the extent to which the observed treatment effect (in the intervention groups) on the primary and key secondary outcomes was mediated by the change in body weight. The lme4 package was used to construct the linear mixed models for the analysis62. This simple mediation analysis partitions the total causal effect into average direct effects (ADE) and average causal mediation effects (ACME; otherwise known as indirect effects). Bias-corrected and accelerated 95% confidence intervals were generated via nonparametric bootstrap analysis (2,000 resamples with replacement).
Todas las comparaciones no basadas en hipótesis (es decir, en los resultados secundarios y exploratorios) se consideran, por definición, exploratorias y apoyan la interpretación del resultado primario. Si la prueba global de significación indicó diferencias entre los grupos (p < 0,1)63, se exploraron todos los resultados (primarios, secundarios, exploratorios y post hoc) en las comparaciones por pares. Aunque no se realizaron correcciones para la multiplicidad, la tasa de error de tipo 1 en el resultado primario se mantuvo mediante un enfoque analítico jerárquico.63. De acuerdo con nuestro SAP preespecificado, las seis hipótesis jerárquicas preespecificadas (basadas en un supuesto de superioridad) se probaron utilizando la secuencia preespecificada: (1) CON versus HED, (2) CON versus MED, (3) CON versus DCON, (4) DCON versus HED, (5) DCON versus MED, (6) MED versus HED. Si no logramos progresar a partir de ninguna de las comparaciones previas entre grupos (p > 0,05), los valores de p posteriores y los intervalos de confianza se consideraron indicadores de asociaciones en lugar de causalidad. El nivel de significación estadística (para la superioridad) se fijó en α < 0,05 (bilateral). Los análisis estadísticos se realizaron utilizando Stata/SE (StataCorp), versión 17.1.
Resumen del informe
Más información sobre el diseño de la investigación está disponible en el resumen de informes de Nature Portfolio vinculado a este artículo.
Disponibilidad de datos
Los datos no están disponibles para su descarga debido a restricciones éticas y de privacidad en virtud del Reglamento General de Protección de Datos de la Unión Europea (RGPD de la UE). Las solicitudes específicas de acceso al ensayo y a los datos biológicos únicos y a nivel individual incluidos en este artículo pueden enviarse a mathias.ried-larsen@regionh.dk. Sobre la base de la solicitud, se puede proporcionar acceso a una persona designada de acuerdo con las normas y reglamentos de la Agencia Danesa de Protección de Datos y el Comité Nacional de Ética de la Investigación en Salud. Las solicitudes serán consideradas a partir de la fecha de publicación de este artículo.
Disponibilidad del código
Los archivos de sintaxis (Stata) están disponibles previa solicitud para mathias.ried-larsen@regionh.dk.
Referencias
- Schwartz, S. S. et al. Una construcción fisiopatológica unificada de la diabetes y sus complicaciones. Tendencias Endocrinol. Metab. 28, 645–655 (2017).Artículo CAS PubMed Google Académico
- Magkos, F. et al. Efectos de la pérdida de peso moderada y progresiva posterior sobre la función metabólica y la biología del tejido adiposo en humanos con obesidad. Celda Metab. 23, 591–601 (2016).Artículo CAS PubMed PubMed Central Google Académico
- Lim, E. L. et al. Reversión de la diabetes tipo 2: normalización de la función de las células beta en asociación con disminución del páncreas y triacilglicerol hepático. Diabetología 54, 2506–2514 (2011).Artículo CAS PubMed PubMed Central Google Académico
- Taylor, R. et al. La remisión de la diabetes tipo 2 humana requiere una disminución en el contenido de grasa del hígado y el páncreas, pero depende de la capacidad de recuperación de células β. Celda Metab. 28, 547–556.e3 (2018).Artículo CAS PubMed Google Académico
- Karstoft, K. et al. Mecanismos detrás de los efectos superiores del intervalo vs el entrenamiento continuo sobre el control glucémico en individuos con diabetes tipo 2: un ensayo controlado aleatorio. Diabetología 57, 2081–2093 (2014).Artículo PubMed Google Académico
- Dela, F., von Linstow, M. E., Mikines, K. J. & Galbo, H. El entrenamiento físico puede mejorar la función de las células beta en la diabetes tipo 2. Am. J. Physiol. Endocrinol. Metab. 287, E1024–E1031 (2004).Artículo CAS PubMed Google Académico
- Rogers, M. A. et al. Mejora en la tolerancia a la glucosa después de 1 semana de ejercicio en pacientes con NIDDM leve. Diabetes Care 11, 613–618 (1988).Artículo CAS PubMed Google Académico
- Krotkiewski, M. et al. Los efectos del entrenamiento físico sobre la secreción y eficacia de la insulina y sobre el metabolismo de la glucosa en la obesidad y la diabetes mellitus tipo 2 (no insulinodependiente). Diabetología 28, 881–890 (1985).Artículo CAS PubMed Google Académico
- Eriksen, L., Dahl-Petersen, I., Haugaard, S. B. & Dela, F. Comparación del efecto de múltiples sesiones de ejercicio de corta duración con sesiones únicas de ejercicio de larga duración sobre la homeostasis de la glucosa en la diabetes mellitus tipo 2. Diabetología 50, 2245–2253 (2007).Article CAS PubMed Google Scholar
- Johansen, M. Y. et al. Effects of an intensive lifestyle intervention on the underlying mechanisms of improved glycaemic control in individuals with type 2 diabetes: a secondary analysis of a randomised clinical trial. Diabetologia 63, 2410–2422 (2020).Article CAS PubMed Google Scholar
- Curran, M. et al. The benefits of physical exercise for the health of the pancreatic β-cell: a review of the evidence. Exp. Physiol. 105, 579–589 (2020).Article PubMed Google Scholar
- Slentz, C. A. et al. Effects of exercise training intensity on pancreatic beta-cell function. Diabetes Care 32, 1807–1811 (2009).Article CAS PubMed PubMed Central Google Scholar
- Zhang, S., Wei, Y. & Wang, C. Impacts of an exercise intervention on the health of pancreatic beta-cells: a review. Int. J. Environ. Res. Public Health 19, 7229 (2022).Article CAS PubMed PubMed Central Google Scholar
- AbouAssi, H. et al. The effects of aerobic, resistance, and combination training on insulin sensitivity and secretion in overweight adults from STRRIDE AT/RT: a randomized trial. J. Appl. Physiol. (1985) 118, 1474–1482 (2015).Article CAS PubMed Google Scholar
- Hannon, T. S. et al. Review of methods for measuring β-cell function: design considerations from the Restoring Insulin Secretion (RISE) Consortium. Diabetes Obes. Metab. 20, 14–24 (2018).Article CAS PubMed Google Scholar
- Karstoft, K. et al. La efectividad de la glucosa, pero no la sensibilidad a la insulina, mejora después del entrenamiento a intervalos a corto plazo en individuos con diabetes mellitus tipo 2: un ensayo controlado, aleatorizado y cruzado. Diabetología 60, 2432–2442 (2017).Artículo CAS PubMed Google Académico
- Davies, M. J. et al. Manejo de la hiperglucemia en la diabetes tipo 2, 2022. Un informe de consenso de la Asociación Americana de Diabetes (ADA) y la Asociación Europea para el Estudio de la Diabetes (EASD). Diabetes Care 45, 2753–2786 (2022).Artículo CAS PubMed Google Académico
- Sathananthan, M. et al. Seis y 12 semanas de restricción calórica aumenta β función celular y disminuye las concentraciones de glucosa en ayunas y posprandial en personas con diabetes tipo 2. J. Nutr. 145, 2046–2051 (2015).Artículo PubMed PubMed Central Google Académico
- Goto, Y. et al. Mejora de la sensibilidad a la insulina del músculo esquelético con 1 semana de uso del inhibidor SGLT2. Endocrino. Conectar. 9, 599–606 (2020).Artículo CAS PubMed PubMed Central Google Académico
- Omar, B. & Ahrén, B. Mecanismos pleiotrópicos para la acción reductora de la glucosa de los inhibidores de DPP-4. Diabetes 63, 2196–2202 (2014).Artículo PubMed Google Académico
- Bahne, E. et al. La secreción de péptido-1 similar al glucagón inducida por metformina contribuye a las acciones de la metformina en la diabetes tipo 2. JCI Insight 3, e93936 (2018).Artículo PubMed PubMed Central Google Académico
- Lyngbaek, M. P. P. et al. Los efectos de diferentes dosis de ejercicio sobre la función pancreática de las células β en pacientes con diabetes tipo 2 recién diagnosticada: protocolo de estudio y justificación detrás del ensayo clínico aleatorizado de grupos paralelos de grupos paralelos de múltiples brazos «DOSE-EX». Ensayos 22, 244 (2021).Artículo CAS PubMed PubMed Central Google Académico
- Malin, S. K. et al. La función de las células β pancreáticas aumenta de manera lineal dosis-respuesta después del entrenamiento físico en adultos con prediabetes. Am. J. Physiol. Endocrinol. Metab. 305, E1248–E1254 (2013).Artículo CAS PubMed PubMed Central Google Académico
- Madsen, S. M., Thorup, A. C., Overgaard, K. & Jeppesen, P. B. El entrenamiento de intervalos de alta intensidad mejora el control glucémico y la función de las células β pancreáticas de los pacientes con diabetes tipo 2. PLoS ONE 10, e0133286 (2015).Artículo PubMed PubMed Central Google Académico
- Malandrucco, I. et al. Dieta muy baja en calorías: una herramienta terapéutica rápida para mejorar la función de las células β en pacientes con obesidad mórbida con diabetes tipo 2. Am. J. Clin. Nutr. 95, 609–613 (2012).Artículo CAS PubMed Google Académico
- Lean, M. E. J. et al. Control de peso dirigido por atención primaria para la remisión de la diabetes tipo 2 (DiRECT): un ensayo aleatorizado grupal abierto. Lancet 391, 541–551 (2018).Artículo PubMed Google Académico
- Kanat, M. et al. Alteración de la secreción de insulina en fase temprana pero no tardía en sujetos con alteración de la glucosa en ayunas. Acta Diabetol. 48, 209–217 (2011).Artículo CAS PubMed Google Académico
- King, D. S. et al. Capacidad secretora de insulina en hombres jóvenes entrenados y no entrenados en resistencia. Am. J. Physiol. Endocrinol. Metab. 259, E155–E161 (1990).Artículo CAS Google Académico
- Dela, F. Adaptación funcional de las células β humanas después de la exposición frecuente a la noradrenalina. J. Physiol. 593, 3199–3206 (2015).Artículo CAS PubMed PubMed Central Google Académico
- Shima, K., Hirota, M., Sato, M., Iwami, T. & Oshima, I. Efecto del entrenamiento físico sobre la liberación de insulina y glucagón del páncreas de rata perfundido. Horm. Metab. Res 19, 395–399 (1987).Artículo CAS PubMed Google Académico
- Vazquez Arreola, E., Hanson, R. L., Bogardus, C. & Knowler, W. C. Relación entre la secreción de insulina y la sensibilidad a la insulina y su papel en el desarrollo de la diabetes tipo 2: más allá del índice de disposición. Diabetes 71, 128–141 (2022).Artículo Google Académico
- Mingrone, G. et al. La sensibilidad a la insulina depende de la vía de administración de la glucosa. Diabetología 63, 1382–1395 (2020).Artículo CAS PubMed PubMed Central Google Académico
- Roberts-Thomson, K. M. et al. La administración oral e intravenosa de glucosa provoca respuestas opuestas del flujo sanguíneo microvascular en el músculo esquelético de personas sanas: papel de las incretinas. J. Physiol. 600, 1667–1681 (2022).Artículo CAS PubMed Google Académico
- Akerstrom, T. et al. El aumento de la capilarización del músculo esquelético mejora la sensibilidad a la insulina. Am. J. Physiol. Endocrinol. Metab. 307, E1105–E1116 (2014).Artículo CAS PubMed Google Académico
- Sylow, L. & Richter, E. A. Avances actuales en nuestra comprensión del ejercicio como medicina en la enfermedad metabólica. Curr. Opinar. Fisioterapeuta. 12, 12–19 (2019).Artículo Google Académico
- Dubé, J. J. et al. Efectos de la pérdida de peso y el ejercicio sobre la resistencia a la insulina, y triacilglicerol, diacilglicerol y ceramida intramiocelulares. Diabetología 54, 1147–1156 (2011).Artículo PubMed PubMed Central Google Académico
- Frías, J. P. et al. Tirzepatide versus semaglutida una vez a la semana en pacientes con diabetes tipo 2. N. Ingl. J. Med. 385, 503–515 (2021).Artículo PubMed Google Académico
- Lundby, C., Montero, D. & Joyner, M. Biología de VO2 Max: Mirando bajo la lámpara de fisiología. Acta Physiol. (Oxf.) 220, 218–228 (2017).Artículo CAS PubMed Google Académico
- Meneilly, GS & Elliott, T. Evaluación de la sensibilidad a la insulina en adultos mayores utilizando la técnica de pinza hiperglucémica. J. Am. Geriatr. Soc. 46, 88–91 (1998).Artículo CAS PubMed Google Académico
- Trabulsi, J. & Schoeller, D. A. Evaluación de instrumentos de evaluación dietética contra agua doblemente etiquetada, un biomarcador de la ingesta habitual de energía. Am. J. Physiol. Endocrinol. Metab. 281, E891–E899 (2001).Artículo CAS PubMed Google Académico
- Kahn, S. E. et al. Efectos de la rosiglitazona, gliburida y metformina sobre la función de las células β y la sensibilidad a la insulina en ADOPT. Diabetes 60, 1552–1560 (2011).Artículo CAS PubMed PubMed Central Google Académico
- Boland, B. B. et al. El reposo pancreático de células β repone la capacidad secretora de insulina y atenúa la diabetes en un modelo extremo de diabetes tipo 2 obesa. Diabetes 68, 131–140 (2019).Artículo CAS PubMed Google Académico
- Colaboración Atlas. Reconstrucción de productos de desintegración hadrónica de leptones tau con el experimento ATLAS. J. C 76, 295 (2016).Artículo Google Académico
- ICH E2A Gestión de datos de seguridad clínica: definiciones y estándares para la notificación acelerada (Agencia Europea de Medicamentos, 1995).
- Henry, C. J. K. Estudios de tasa metabólica basal en humanos: medición y desarrollo de nuevas ecuaciones. Nutr. Salud Pública Nutr. 8, 1133–1152 (2005).Artículo CAS PubMed Google Académico
- Helms, E. R., Cronin, J., Storey, A. & Zourdos, M. C. Aplicación de las repeticiones en la calificación basada en reservas de la escala de esfuerzo percibido para el entrenamiento de resistencia. Fuerza Cond. J. 38, 42–49 (2016).Artículo PubMed PubMed Central Google Académico
- Ørskov, C., Rabenhøj, L., Wettergren, A., Kofod, H. & Holst, J. J. Concentraciones tisulares y plasmáticas del péptido similar al glucagón I amidado y extendido con glicina en humanos. Diabetes 43, 535–539 (1994).Article PubMed Google Scholar
- Wewer Albrechtsen, N. J. et al. Stability of glucagon-like peptide 1 and glucagon in human plasma. Endocr. Connect. 4, 50–57 (2015).Article PubMed PubMed Central Google Scholar
- Lindgren, O. et al. Incretin hormone and insulin responses to oral versus intravenous lipid administration in humans. J. Clin. Endocrinol. Metab. 96, 2519–2524 (2011).Article CAS PubMed Google Scholar
- Steele, R. Influences of glucose loading and of injected insulin on hepatic glucose output. Ann. N. Y. Acad. Sci. 82, 420–430 (1959).Article CAS PubMed Google Scholar
- Plomgaard, P. et al. Tumor necrosis factor-alpha induces skeletal muscle insulin resistance in healthy human subjects via inhibition of Akt substrate 160 phosphorylation. Diabetes 54, 2939–2945 (2005).Article CAS PubMed Google Scholar
- Matthews, D. E. Radioactive and Stable Isotope Tracers in Biomedicine: Principles and Practice of Kinetic Analysis: by Robert R Wolfe, 1992, 471 pages, hardcover, $89.95. John Wiley & Sons, Inc, Somerset, NJ. Am. J. Clin. Nutr. 58, 452 (1993).Article Google Scholar
- Maki, K. C., McKenney, J. M., Farmer, M. V., Reeves, M. S. & Dicklin, M. R. Indices of insulin sensitivity and secretion from a standard liquid meal test in subjects with type 2 diabetes, impaired or normal fasting glucose. Nutr. J. 8, 22 (2009).Article PubMed PubMed Central Google Scholar
- Van Cauter, E., Mestrez, F., Sturis, J. & Polonsky, K. S. Estimation of insulin secretion rates from C-peptide levels: comparison of individual and standard kinetic parameters for C-peptide clearance. Diabetes 41, 368–377 (1992).Article PubMed Google Scholar
- White, I. R., Horton, N. J., Carpenter, J. & Pocock, S. J. Strategy for intention to treat analysis in randomised trials with missing outcome data. BMJ 342, d40 (2011).Article PubMed PubMed Central Google Scholar
- Detry, M. A. & Lewis, R. J. El principio de intención de tratar: cómo evaluar el verdadero efecto de elegir un tratamiento médico. JAMA 312, 85–86 (2014).Artículo CAS PubMed Google Académico
- Coffman, C. J., Edelman, D. & Woolson, R. F. ¿Acondicionar o no condicionar? Analizar el «cambio» en los ensayos controlados aleatorios longitudinales. BMJ Open 6, e013096 (2016).Artículo PubMed PubMed Central Google Académico
- Rubin, D. B. Imputación múltiple después de 18+ años. J. Am. Stat. Assoc. 91, 473–489 (1996).Artículo Google Académico
- Greenland, S., Mansournia, M. A. & Altman, D. G. Sparse data bias: a problem hiding in plain sight. BMJ 352, i1981 (2016).Artículo PubMed Google Académico
- Kirk, S., Scott, B. J. & Daniels, S. R. Epidemia de obesidad pediátrica: opciones de tratamiento. J. Am. Dieta. Assoc. 105, S44–S51 (2005).Artículo PubMed Google Académico
- R: un lenguaje y entorno para la computación estadística. (Fundación R para la Computación Estadística, 2018).
- Bates, D., Machler, M., Bolker, B. & Walker, S. lme4: linear mixed-effects models using Eigen and S4; https://github.com/lme4/lme4 (2022).
- Dmitrienko, A. & D’Agostino, R. B.Sr. Multiplicidad consideraciones en ensayos clínicos. N. Ingl. J. Med. 378, 2115–2122 (2018).Artículo PubMed Google Académico
Agradecimientos
Agradecemos a los participantes del estudio por su tiempo y participación en este estudio, así como al personal actual y anterior de CFAS, Rigshospitalet. También agradecemos al personal actual y anterior del Centro de Investigación de la Diabetes de la Municipalidad de Copenhague por su apoyo en el reclutamiento y la entrega de intervenciones. El proyecto fue apoyado por una subvención de TrygFonden y Svend Andersen Fonden. CFAS es compatible con TrygFonden (concede ID 101390, ID 20045 e ID 125132). R.C. pertenece a la Sección de Bioestadística e Investigación Basada en la Evidencia, el Instituto Parker, el Hospital Bispebjerg y Frederiksberg, que cuenta con el apoyo de una subvención básica de la Fundación Oak (OCAY-18-774-OFIL). M.P.P.L. fue apoyado por una beca de investigación de la Academia Danesa de Diabetes (subvención no. NNF17SA0031406), que está financiada por la Fundación Novo Nordisk.
Información del autor
Notas del autor
- Estos autores contribuyeron igualmente: Grit E. Legaard, Mark P.P. Lyngbæk.
Autores y afiliaciones
- Centro de Investigación de la Actividad Física, Rigshospitalet, Copenhague, DinamarcaGrit E. Legaard, Mark P. P. Lyngbæk, Kristian Karstoft, Sebastian L. Bennetsen, Camilla S. Feineis, Nina S. Nielsen, Cody G. Durrer, Benedikte Liebetrau, Ulrikke Nystrup, Martin Østergaard, Katja Thomsen, Beckey Trinh, Bente K. Pedersen y Mathias Ried-Larsen
- Departamento de Endocrinología PE, Rigshospitalet, Universidad de Copenhague, Copenhague, DinamarcaThomas P. Almdal
- Department of Immunology & Microbiology, University of Copenhagen, Copenhagen, DenmarkThomas P. Almdal
- Department of Clinical Pharmacology, Bispebjerg-Frederiksberg Hospital, University of Copenhagen, Copenhagen, DenmarkKristian Karstoft
- Blazon Scientific, London, UKThomas P. J. Solomon
- Biomedical Sciences, Faculty of Health & Medical Science, University of Copenhagen, Rigshospitalet, Copenhagen, DenmarkGerrit Van Hall
- Clinical Metabolomics Core Facility, Clinical Biochemistry, University of Copenhagen, Rigshospitalet, Copenhagen, DenmarkGerrit Van Hall
- Department of Sports Science and Clinical Biomechanics, University of Southern Denmark, Odense, DenmarkJan Christian Brønd & Mathias Ried-Larsen
- Department of Biomedical Sciences and the Novo Nordisk Foundation Center for Basic Metabolic Research, University of Copenhagen, Copenhagen, DenmarkJens J. Holst & Bolette Hartmann
- Sección de Bioestadística e Investigación Basada en la Evidencia, Instituto Parker, Hospital Bispebjerg y Frederiksberg, Copenhague, DinamarcaRobin Christensen
- Unidad de Investigación de Reumatología, Departamento de Investigación Clínica, Universidad del Sur de Dinamarca, Odense, DinamarcaRobin Christensen
Contribuciones
B.K.P., K.K., T.P.A. y M.R.-L. concibió el estudio. M.P.P.L., G.E.L. y M.R.-L. escribió el primer borrador. M.R.-L. es el investigador principal. M.R.-L., M.P.P.L. y G.E.L. tuvieron pleno acceso a los datos del estudio, verificaron los datos y tuvieron plena responsabilidad por la decisión de presentar y publicar. M.P.P.L., G.E.L., M.R.-L., T.P.A., K.K., B.K.P., T.P.J.S., R.C., G.V.H. y J.J.H. contribuyeron al desarrollo del protocolo y al diseño del estudio. G.E.L., M.P.P.L., S.L.B., C.S.F., N.S.N., B.L., U.N., M.Ø., K.T. y B.T. realizaron los experimentos y recopilaron los datos. T.P.A. y K.T. realizaron el manejo farmacológico. B.H., J.J.H. y G.V.H. realizaron análisis bioquímicos de incretinas o isótopos estables. J.C.B. realizó los análisis del acelerómetro. M.R.-L., K.T., N.S.N., G.E.L. y M.P.P.L. integraron y verificaron la calidad de los datos. M.R.-L. y C.G.D. realizó los análisis estadísticos. G.E.L., M.P.P.L., R.C. y M.R.-L. escribió el SAP. Todos los autores leyeron el SAP, lo revisaron críticamente para el contenido intelectual importante y aprobaron la versión final. Todos los autores leyeron el manuscrito, lo revisaron críticamente para un contenido intelectual importante y aprobaron la versión final.
Autor para correspondencia
Correspondencia a Mathias Ried-Larsen.
Declaraciones éticas
Conflictos de intereses
J.J.H. es miembro de los consejos asesores de Novo Nordisk. Todos los demás autores declaran que no tienen intereses contrapuestos.
Revisión por pares
Información de revisión por pares
Nature Metabolism agradece a los revisores anónimos por su contribución a la revisión por pares de este trabajo. Editora principal de manejo: Isabella Samuelson, en colaboración con el equipo de Nature Metabolism.
Información adicional
Nota del editor Springer Nature se mantiene neutral con respecto a las reclamaciones jurisdiccionales en los mapas publicados y las afiliaciones institucionales.
Datos ampliados
Datos extendidos Fig. 1 Diagramas de caja para valores basales y por grupo en el seguimiento.
Como los análisis primarios se realizan utilizando un modelo de referencia restringido, donde se supone que todos los grupos son similares a una línea de base, los valores de referencia no se representan por grupo. Los círculos denotan los valores individuales del participante. La línea central son los valores medios, el área gris claro es el rango intercuartil inferior, el área gris oscura es el rango intercuartil superior, los bigotes muestran + /-1.5 x el rango intercuartílico, CON: grupo control (N = 20 muestras independientes), DCON: Grupo de control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes), DI: Índice de disposición, ISI: Índice de sensibilidad a la insulina, ISR: Tasa de secreción de insulina, pmol: pico mol, mmol: mili mol, u.a.: unidades arbitrarias, kg: kilogramos.
Datos extendidos Fig. 2 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. El tiempo 0-120 minutos es la fase hiperglucémica. El tiempo de 120-180 minutos es la fase de estimulación hiperglucémica y GLP-1. El tiempo 180-190 minutos es la fase de estimulación hiperglucémica, GLP-1 y arginina HCl. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 3 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 4 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 5 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 6 Representado como las medias estimadas.
Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 7 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Datos extendidos Fig. 8 Los círculos negros representan valores de referencia y los círculos rojos representan los valores de seguimiento de 16 semanas.
Los datos se representan como las medias estimadas. Las barras de error son intervalos de confianza del 95%. Los resultados se ajustan por sexo. CONTRA: grupo control (N = 20 muestras independientes), DCON: grupo control dietético (N = 21 muestras independientes), MED: Ejercicio de volumen moderado (N = 20 muestras independientes), HED: Ejercicio de alto volumen (N = 21 muestras independientes).
Información complementaria
Información complementaria
Lista de verificación CONSORT, protocolo publicado, resumen del análisis estadístico planificado previamente y protocolo de estudio aprobado.
Resumen del informe
Cuadros suplementarios
Resumen de la tabla suplementaria y Tablas suplementarias 1–16.
Derechos y permisos
Acceso abierto Este artículo está bajo una Licencia Creative Commons Atribución 4.0 Internacional, que permite el uso, intercambio, adaptación, distribución y reproducción en cualquier medio o formato, siempre y cuando se dé el crédito apropiado al autor original (s) y la fuente, proporcione un enlace a la licencia Creative Commons e indique si se realizaron cambios. Las imágenes u otro material de terceros en este artículo se incluyen en la licencia Creative Commons del artículo, a menos que se indique lo contrario en una línea de crédito del material. Si el material no está incluido en la licencia Creative Commons del artículo y su uso previsto no está permitido por la regulación legal o excede el uso permitido, deberá obtener el permiso directamente del titular de los derechos de autor. Para ver una copia de esta licencia, visite http://creativecommons.org/licenses/by/4.0/.
Acerca de este artículo
Citar este artículo
Legaard, G.E., Lyngbæk, M.P.P., Almdal, T.P. et al. Efectos de diferentes dosis de ejercicio y pérdida de peso inducida por la dieta sobre la función de las células beta en la diabetes tipo 2 (DOSE-EX): un ensayo clínico aleatorizado. Nat Metab (2023). https://doi.org/10.1038/s42255-023-00799-7
- Recibido18 enero 2023
- Aceptado04 abril 2023
- Publicado01 mayo 2023
- DOIhttps://doi.org/10.1038/s42255-023-00799-7
- Fuente: https://www.nature.com/articles/s42255-023-00799-7
